2.北京农林科学院蔬菜研究中心, 北京, 100097
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 18 篇 doi: 10.5376/mpb.cn.2012.10.0018
收稿日期: 2012年03月14日 接受日期: 2012年04月09日 发表日期: 2012年05月15日
引用格式(中文):
韩笑等, 2012, 浸花转化技术中不结球白菜与拟南芥的比较研究, 分子植物育种(online) Vol.10 No.18 pp.1133-1137 (doi: 10.5376/mpb.cn.2012.10.0018)
引用格式(英文):
Han et al., 2012, AComparative Study of the Floral-dip Technique in Pak choi (Brassica campestrisssp. Chinensis L.) and Arabidopsis thaliana, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.18 pp.1133-1137 (doi: 10.5376/mpb.cn.2012.10.0018)
为了探索建立白菜的浸花转化技术,并阐释其转化率低的原因,本研究以拟南芥为对照,平行开展了二者的浸花转化研究。处理植株收获种子采用含0.225 g/Lppt的Basta溶液喷施,拟南芥中获得了抗性株,其植株转化率为20%,白菜中没有获得抗性株。GUS检测进一步证明了拟南芥抗性株中外源基因的表达。以浸花处理后的拟南芥和白菜为材料,采用细菌平板培养的方法比较研究了这两种植物花器官内农杆菌的数量差异。研究结果表明,在同样的处理条件下,自拟南芥花蕾提取物中培养出一定数量的农杆菌菌落单元,然而白菜花蕾提取液中没有出现菌落单元。这说明农杆菌很难通过浸花处理进入白菜花器官内,在一定程度上解释了为何白菜的转化频率远远低于拟南芥。
农杆菌介导的floral-dip转化方法是近年发展起来的一种较简便的非组织培养转基因方法(韦献雅等, 2006)。该方法最大的优点在于可以直接获得转化的种子,避开了组织培养和继代培养,相对于真空转化也拥有对仪器设备要求较低,适用于大型植株等优势。该方法首先在拟南芥中获得了成功,在甘蓝型油菜等植物上也已经有成功转化的报道(徐光硕等, 2004)。然而该方法在白菜中还未见有成功转化的例子。初步研究发现,拟南芥原位转化中,农杆菌的转化目标是雌性生殖细胞,在白菜中也可能遵循同样的规律。本实验对不结球白菜和拟南芥两种试材进行了平行浸花实验,多次实验证明在拟南芥中可以获得转化株,而白菜中未能获得。之后采用细菌平板培养的方法对浸花后的两种材料花器官中的农杆菌活力大小进行了比较分析。实验结果对探索白菜的浸花转化方法提供了一些理论依据。
1结果与分析
1.1浸花处理后的白菜和拟南芥T1代种子抗性筛选结果
使用Basta®对浸花材料的T1代种子进行抗性筛选,ppt筛选压为0.225 g/L。本实验共对拟南芥和不结球白菜“引心360”各15株进行了浸花实验,浸花后两种实验材料结籽情况良好。考虑到拟南芥的种子细小,难以对结籽数进行统计,本实验对两种实验材料进行了株转化率的比较。T1代种子筛选结果中,拟南芥得到除草剂Basta抗性株3棵,“引心360”未获得抗性株(表1)。
表1 拟南芥和引心360浸花法的转化率比较 |
1.2 GUS外源基因表达检测结果
对经Basta筛选获得的拟南芥抗性植株的叶片和幼嫩茎杆进行GUS基因表达稳定性检测,得出在抗性植株的叶片和茎杆中组织化学染色结果均显阳性。研究结果初步表明:外源基因已导入拟南芥基因组(图1)。
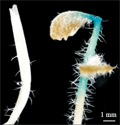 图1 抗性植株GUS检测 |
1.3拟南芥和白菜花器官中农杆菌数的定量分析
多次的浸花实验筛选结果表明,拟南芥较容易得到转化株,而多个白菜品种(“四九菜心”, “引心360”和“引心400”)经转化均未获得转化株。这说明目前利用浸花技术对白菜进行转化存在一定的困难。
本实验采用细菌平板培养菌落计数法,对拟南芥和不结球白菜“引心360”两种材料花器官中存活的农杆菌数量差异大小进行了调查。该结果在一定程度上解释了拟南芥和白菜转化存在差异的原因。
1.3.1花蕾提取液中培养出的菌落验证结果
菌落鉴定的目的是为了验证实验材料花器官内培养出的细菌是否为转化所用的工程菌。
1.3.1.1菌落形态鉴定
将浸花处理后的拟南芥花器官提取液涂板,筛选平板培养出的菌落外表光滑呈圆形,凸起发亮,符合农杆菌的菌落特征(徐恒戬等, 2005)。非转基因拟南芥花蕾提取液则没有培养出菌落(图2)。
图2 农杆菌培养平板 |
1.3.1.2菌落抗性鉴定
培养基中的卡那霉素已经对平板上形成的菌落进行了初步的筛选。鉴于转化所用的工程菌同时还对利福霉素有抗性,因此可以用含有利福霉素的液体培养基对平板上的细菌进行培养,观察其能否正常生长。事实证明,所有被鉴定的单菌落在液体选择培养基中过夜震荡培养后都会变浑浊,这表明除了卡那霉素,它们也同样具有利福霉素的抗性基因。
1.3.1.3菌落分子鉴定
采用GUS基因的扩增引物直接对实验材料花器官中培养出的菌落进行PCR扩增。电泳结果表明,用于PCR验证所选的7个农杆菌菌落中的DNA片段扩增出的条带,均与阳性对照质粒(转化所用质粒)完全一样,大小为1 000 bp (图3)。这表明,浸花处理后的花蕾提取物中培养出的细菌正是用于转化的工程菌。
 图3 GUS基因的PCR鉴定 |
1.3.2拟南芥和不结球白菜“引心360”花器官中的农杆菌数量差异比较
细菌平板计数结果表明在拟南芥和菜心经过浸花处理的花器官中,形成菌落单元(cloning formation unit, CFU)差异显著。结果表明,在10-5倍稀释下仍可在处理后的拟南芥花蕾提取物中培养出一定数量的农杆菌菌落单元;而在同样的处理条件下,浸花后的白菜花器官中却几乎没有培养出农杆菌菌落单元,这与拟南芥花器官中农杆菌的培养结果相比有明显的差异(表2)。
表2 拟南芥和引心360花蕾提取液农杆菌菌落形成数量比较(CFUs/g) |
2讨论
Floral dip法的试验材料是花序,Bechtold和Pelletier (1998)、Desfeux (2000)等的研究结果表明,floral dip法中农杆菌的转化目标是雌性生殖细胞。
本实验对拟南芥和白菜处理后花蕾的提取液进行了农杆菌的平板培养,其CFU比较结果差异显著,说明大量的农杆菌并没有成功的在白菜花器官中存活。这也解释了为何多次的白菜浸花实验没有获得转化株。
2.1花的结构对转化的影响
浸花法的实验材料是花序,首先应当考虑花器官的结构对转化事件的影响。白菜花器官中未能培养出与拟南芥数量相当的农杆菌,其中一种原因可能是大量农杆菌未能顺利进入白菜植株中。花萼花被闭合过紧,植株表面有绒毛或蜡质,都是阻碍农杆菌进入的潜在原因。在原位转化技术中,不结球白菜“四九菜心”通过真空转化的方法被成功转化,由此推断外界的压力对农杆菌的浸入可能有着促进作用(曹传增等, 2003; Xu et al., 2008)。
另外花序中处于不同发育期的花蕾数在总花蕾中所占的比例及花发育节律存在一定的差异。Desfeux (2000)等研究发现,拟南芥中对于6~11 d才开花的花蕾,经浸花处理后有转化株产生。而对于接种后1~4 d就开放的花蕾,其后代种子中完全没有转化株。而运用拟南芥心皮不闭合型突变体(crc),使转化率提高了近6倍。可以推断心皮处于开放状态的花蕾有利于转化事件的发生。还有研究表明拟南芥中心皮在开花前3 d才闭合,而不结球白菜“四九菜心”中,心皮早在花蕾开放的10 d以前就发生了闭合,认为心皮的闭合时间是造成菜心的转化效率低于拟南芥的主要原因(Cao et al., 2000)。
2.2植物体内农杆菌的生存
由实验结论得出的另一个推断,是白菜植株体内的微环境对农杆菌的存活可能是不利的。CFU调查发现,植株中农杆菌的活力受到了严重的抑制,涂板后三天内不能培养出大小正常的菌落。相似的情况在徐恒戬等(2005)的研究中也有指出,并表明无论在花,茎还是叶中,CFU数量随着植株处理后恢复时间的延长迅速减少。
农杆菌在植株体内的长期生存有利于遗传转化。在植物组织中得以生存的农杆菌可能通过对种质细胞的转化产生可遗传的转基因植株。 Rakousky (1997)等对农杆菌渗透处理后的拟南芥进行了GUS瞬时表达研究,发现农杆菌能在处理植株的表面和内部存活很长一段时间,即便是在处理后3~6 d的植株中,植物组织中的农杆菌数量仍可以达到1.2×108个/g (Rakousky, 1997)。这说明拟南芥体内的环境可能有利于农杆菌的存活,一方面也解释了浸花转化技术中拟南芥为何可以获得较高的转化效率。
细菌平板培养的结果在某一方面解释了在浸花转化中,拟南芥的转化频率为何远远高于白菜。在同样的浸花条件下,大量的活的农杆菌进入了拟南芥体内,并存活了相当一段时间(浸花后8天在稀释1 000倍下花器官中仍培养出一定数量的农杆菌菌落单元)。
3实验材料与方法
3.1材料
3.1.1植物材料
采用不结球白菜“引心360”和拟南芥为试材。
3.1.2工程菌
农杆菌为C58菌株,菌株携带的质粒T-DNA中含有标记基因bar (编码对除草剂Basta的抗性)和GUS报告基因,具有利福霉素和卡那霉素的抗性。
3.1.3试剂
实验所用常规试剂及染色试剂均购自北京益利精细化学公司,PCR试剂购自天根生物工程有限公司,引物由奥科生物工程有限公司合成。
3.2浸花处理
处理材料为蕾期植株,处理方法参照Clough和Bent等(1998)。收集过夜培养的菌体重悬浮在含0.04% 6-BA,0.05% Silwet L-77,5%蔗糖的1/2MS液体培养基中,OD600=0.9。将花序浸没入农杆菌悬浮液中,浸花时间为1.5 min,处理两次,每次间隔5 d。
3.3种子抗性筛选
将浸花后的植株收得的种子播于苗盘中,于子叶期喷洒ppt浓度为0.225 g/L的Basta溶液。一共喷洒两次,每次间隔7 d。
3.4 GUS基因的活性检测
取抗性植株的叶片和幼嫩茎杆进行GUS表达稳定性检测,验证目的基因是否已经导入受体植株(付绍红等, 2004)。
3.5处理植株花蕾中农杆菌的培养
浸花处理后的植株,称取花蕾0.1 g左右,3%次氯酸钠表面消毒10 min,花蕾的研磨和提取液的梯度稀释方法参照徐恒戬等(2005)。以未做浸花处理的植株提取液为对照,将稀释好的花蕾提取液涂板培养。农杆菌筛选培养基配方:每1 L培养基中含甘露糖醇15 g,Ca(NO3)2•2H2O:20 mg,NaNO3:5 g ,KH2PO4:2 g,LiCl:6 g,MgSO4•7H2O:0.2 g,溴百里酚蓝0.1 g,琼脂15 g,pH 7.2。高温高压灭菌冷却后加入卡那霉素至终浓度100 mg/L。
3.6对花蕾提取液中培养出的菌落进行验证
3.6.1筛选平板中菌落的形态鉴定
在筛选平板中长出的菌落,已经通过了卡那霉素的初步筛选。观察生长出的菌落外观是否符合农杆菌菌落在筛选培养基中的特点。
3.6.2利福霉素的抗性鉴定
随机挑取农杆菌筛选平板上的单菌落,独立接种到1 mL YEB+50 μg/mL Kan+25 μg/mL Rif的液体培养基中,28℃,200 r/min避光过夜培养。观察培养基的颜色变化,转化所用工程菌由于同时具有利福霉素和卡那霉素的抗性,会在含有这两种抗生素的培养基中正常生长(徐恒戬等, 2005)。
3.6.3分子鉴定
采用菌落PCR对平板中培养出的菌落进行分子鉴定,GUS基因引物序列如下:primer-L:5'-CAACTGGACAAGGCACTAGCGG-3';primer-R:5'-CCATACCTGTTCACCGACGACG-3'。PCR反应体系(20 μL):10× buffer 2 μL,dNTP (10 mmol/L) 0.4 μL,Primer-L/R (50 μmol/L)各0.4 μL,plasmid DNA 100 ng,Taq酶1 U。
反应条件:94℃ 4 min,94℃ 30 s,62℃ 30 s,72℃ 30 s,30个循环,4℃保存。
作者贡献
刘凡老师是项目的构思者和负责人,指导实验设计,数据分析,论文写作与修改;在此研究中韩笑完成了论文初稿的写作,数据分析以及结果分析。曲志才老师,陆坤老师和王桂香老师指导作者完成了实验。全体作者都阅读并同意最终的文本。
致谢
本研究由国家863项目(2008AA10Z154)和北京市科技合同项目(Z07070501770704)共同资助。
参考文献
Bechtold N., and Pelletier G., 1998, In planta Agrobacterium-mediated transformation of adult Arabidopsis thaliana plants by vacuum infiltration, Methods in Molecular Biology, 82: 259-266
PMid:9664431
Cao C.Z., Liu F., Zhao H., Cai M.H., and Xu H.J., 2003, Several factors affecting the vacuum infiltration gene transformation in non-heading chinese cabbage, Huabei Nongxuebao (Acta Agriculturae Boreali-Sinica), 18(4): 35-38 (曹传增, 刘凡, 赵泓, 蔡民华, 徐恒戬, 2003, 影响不结球白菜真空渗入转基因频率的几个因素, 华北农学报, 18(4): 35-38)
Cao M.Q., Liu F., Yao L., David B.,, Colette T., Li Y., and Christophe R., 2000, Transformation of pakchoi (Brassica rapa L. ssp. chinensis) by Agrobacterium infiltration, Molecular Breeding, 6(1): 67-72
http://dx.doi.org/10.1023/A:1009658128964
Clough S.J., and Bent A.F., 1998, Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana, The Plant Journal, 16(6): 735-743
http://dx.doi.org/10.1046/j.1365-313x.1998.00343.x PMid:10069079
Desfeux C., Clough S.J., and Bent A.F., 2000, Female reproductive tissues are the primary target of Agrobacterium-mediated transformation by the Arabidopsis floral-dip method, Plant Physiology, 123(3): 895-904
http://dx.doi.org/10.1104/pp.123.3.895 PMid:10889238 PMCid:59052
Fu S.H., Niu Y.Z., Yang H.Q., 2004, Effects of surfactant silwet-77 on the floral-dip transformation of B. napus, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 2(5): 661-666 (付绍红, 牛应泽, 杨洪全, 2004, 表面活性剂silwetL-77对floral-dip转化甘蓝型油菜效果的影响, 分子植物育种, 2(5): 661- 666)
Rakouský S., Kocábek T., Vincenciová R., and Ondřej M., 1997, Transient β-glucuronidase activity after infiltration of Arabidopsis thaliana by Agrobacteium tunefaciens, Biologia Plantarum, 40(1): 33-41
http://dx.doi.org/10.1023/A:1000988316206
Wei X.Y., Fu S.H., and Niu Y.Z., 2006, Progress in floral-dip method in gene transformation mediated by Agrobacterium, Zhongguo Youliao Zuowu Xuebao (Chinese journal of oil crop sciences), 28(3): 362-367 (韦献雅,付绍红, 牛应泽, 2006, 农杆菌介导floral-dip转基因方法研究进展, 中国油料作物学报, 28(3): 362-367)
Xu G.S., Rao W.Q., Chen Y., Zhang C.Y., and Meng J.L., 2004, Genetic transformation of Brassica napus with in planta method, Zuowu Xuebao (Acta Agronomica Sinica ), 30(1): 1-5 (徐光硕, 饶勇强, 陈雁, 张椿雨, 孟金陵, 2004, 用in planta方法转化甘蓝型油菜, 作物学报, 30(1): 1-5)
Xu H.J, Wang X.F., Zhao H., and Liu F., 2008An intensive understanding of vacuum infiltration transformation of pakchoi (Brassica rapa ssp. chinensis), Plant Cell Reports, 27(8): 1369-1376
http://dx.doi.org/10.1007/s00299-008-0564-3 PMid:18542966
Xu H.J., Liu F., Wang X.F., and Zhao H., 2005, The distribution and viability changes of the Agrobacteria in the vacuum infiltrated plants of Chinese cabbage, Weishengwu Xuebao (Acta Microbiologica Sinica), 45(4): 621-624 (徐恒戬, 刘凡, 王秀峰, 赵泓, 2005, 真空渗入转化法中农杆菌在植株体内的分布和活力变化, 微生物学报, 45(4): 621-624)